
隨著人們生活水平的提高,化妝品逐步(bù)進入了我們(men)的生活,日常生活中我們人人都會與化妝品接觸。由於我們的使用頻率較高,所(suǒ)以化(huà)妝品的質量好壞會影(yǐng)響我們的身體健康,我們需要重視(shì)。化妝(zhuāng)品檢(jiǎn)測主要是關注重金屬、微生物、抗生素、激素、毒理、抗生素、標準禁止添加項目等。
範圍:
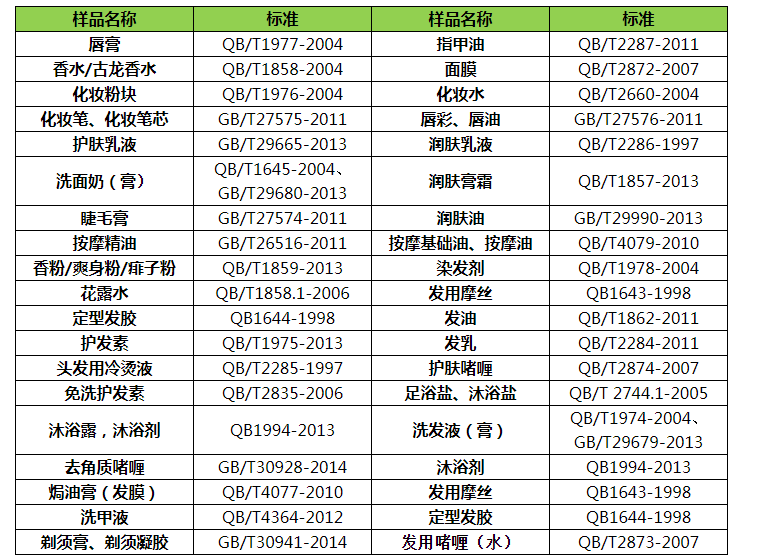
清潔類:牙膏、洗麵奶(膏(gāo))、洗發液(膏)、香皂、足(zú)
浴(yù)鹽/沐浴鹽、沐浴劑等
護膚類:潤膚乳液、潤膚(fū)膏霜等
滋(zī)養類:化(huà)妝水、麵(miàn)膜、護發素、發乳、發油等
美(měi)容類(lèi):化妝粉塊、唇(chún)膏、香水/古龍水、香粉/爽身粉/痱子粉、定型(xíng)發膠、發用摩絲(sī)、染發劑花(huā)露水、指甲油(yóu)等
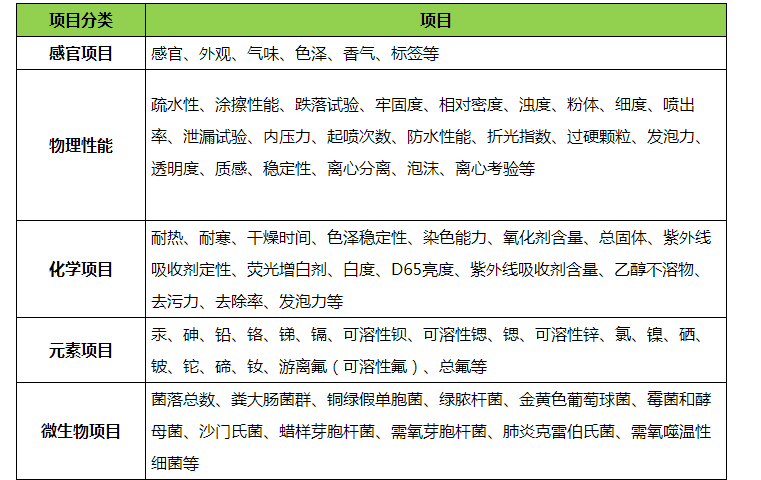

化妝(zhuāng)品非特備案
特殊用途化妝品分別是:育(yù)發、染發、燙發、脫毛、美乳、健美、除臭、祛斑和防曬9類化(huà)妝品,除此之外的化(huà)妝品叫(jiào)做非特殊用途化妝品,也就是普通化妝品(pǐn)。
一、凡在(zài)中華人民共和國境內生產(chǎn)的非特殊用途化妝品,生產企業應按本規定要求進行產品信息備(bèi)案。
二、生產企業應當在產品(pǐn)上市銷售前,將產品配方(不包括(kuò)含量,限用物(wù)質除(chú)外)及銷售(shòu)包裝(含產品(pǐn)標簽、產品說明書)的信息按要求通過(guò)統一的(de)網絡平台報送至所在行政區域內的省級食品藥品監管部門。產品安全性評估資料、產品生(shēng)產工藝簡述、產品生產(chǎn)設備清單、產品技術(shù)要求及產品檢驗報告等資料由生產企業妥善保存備查。
三、委托生產的產品,委托雙方(fāng)應分別向所在行(háng)政區域內的省級食品藥品監督管理部(bù)門報送備案信息。僅供出口的,由實際生產企業向所在行政區域內的省級食品藥品監督管理部門(mén)報送備案(àn)信息。
四、省級(jí)食品藥品監督(dū)管理部門收到企業的備案信息後,應當在5個工(gōng)作日內完成對備(bèi)案資料完整性的核查。符合要求的(de),通過國家食品藥品監管總(zǒng)局政務網公布產品備案信息(xī),供公眾查詢。
五、對於不(bú)屬於備案產品範圍的、備(bèi)案資料不齊全或備案資料不符合規定形式的,省(shěng)級食品藥品(pǐn)監督管理(lǐ)部門應在5個工作日內告知企業並說明理由。存在明顯(xiǎn)違法情形的,應當責令立(lì)即(jí)改正,不(bú)得上市銷(xiāo)售。
六、省級食品藥(yào)品監督部門應當在備案後三個月(yuè)內(nèi)組織開展對備案產品的實質審(shěn)查,發現不符合國家相關規定的,應當依法予以查處。
七、已經備案的(de)產品,擬變更原備案事項的,應在變更前將相關(guān)變更信(xìn)息報送備案。涉及備案管理部門改變的,應主動申請注銷原(yuán)備案信息後(hòu),直接申請(qǐng)重新備案。
八、已(yǐ)獲備案的(de)產品,自備案之日起每滿4年應重新按本規定要求(qiú)提交產品備(bèi)案信息。
九、產品配方信息的報送應符合以下(xià)要求:
1.全部原料應詳細列明標準中文名稱(chēng)、原(yuán)料序號(hào)、限用物質含量、使用目的(de)等內容。
2.複配原料應以複配形式填報(bào),應標明各組分的(de)標準中文名稱(chēng)。香精不須列明具體香料組分(fèn)的種類(lèi)和含量。
3.原料(含複(fù)配原料中(zhōng)的各組分)應按《國際化妝品原料標準中文名稱目錄》使用標準中文名稱,無國際化妝品原料名稱(INCI)或未列入《國際化妝品原料標準中文名稱目錄》的,應使用《中國藥(yào)典》中的名稱或化學名稱或植物拉丁學名,不得使用商品名或俗名,但複配原料除外。
4.著色劑應提供《化妝品衛生規範》中載明的著色劑索引號(簡稱CI號),無CI號的除外。
5.凡在產品配方中使用來源於石油、煤焦油的碳氫化(huà)合物的(單一(yī)組分的除外),應標明相關原料的化學文摘索引號(簡稱CAS號)。
6.使用動物(wù)髒器組織及血液製品提取物的原(yuán)料,應當收集(jí)該原料的來源、質量規(guī)格和(hé)原(yuán)料生產國允許使(shǐ)用的證明等資料存檔備查。
7.使用《化妝品衛生規範》對限用物質(zhì)有規格要求的原料,應當收集該原料生產商出具的原料質量規格證明存檔備查(chá)。
8.宣(xuān)稱為兒童或嬰兒使用的(de)產品(pǐn),配方設(shè)計原則(含配方整體分析報告)、原料的選擇原(yuán)則和要求、生產(chǎn)工藝、質量控製等內容應當按照《兒童化妝品申報與審評(píng)指南(nán)》(國食(shí)藥監保化(huà)[2012]291號)的要求編製,相關資(zī)料應當(dāng)存檔備查。
9、產品技術(shù)要求的編製參照《關於印發化妝品產品技(jì)術要求規範的通(tōng)知》(國食藥監許[2010]454號)要求執(zhí)行(háng);檢驗要求參照(zhào)《關於印發化妝品行政許可(kě)檢(jiǎn)驗管理辦法的通(tōng)知》(國食藥監許[2010]82號)執行,其中企業參照(zhào)《關於印發化妝品中可能存在的安全性風(fēng)險物質風險(xiǎn)評估指南的通知》(國食藥監許[2010]339號)要求(qiú)進行(háng)風(fēng)險評估並確認產品安全性的,可免(miǎn)做毒理相關檢測。
浙江和諾檢測技術有限(xiàn)公司可以提供樣品送檢服務,進行非特備案的谘詢和指導。
歐(ōu)盟(méng)CPSR(化妝品安全報(bào)告)
CPSR(化妝品安(ān)全報告)是產品進入歐盟(méng)市場的通行證,歐盟化妝品(pǐn)新法規Regulation(EC)1223/2009已(yǐ)於2013年7月11日正式實施,相比於之前的化妝品指令Directive 76/768 EEC,對化妝品的安全性提出了更加嚴格的要求,其中明確規定了產品(pǐn)必須完成化妝品安全報告(gào)(Cosmetic Product Safety Report,CPSR)後方能夠在歐(ōu)盟經濟區上市銷(xiāo)售。
根據新法(fǎ)規,歐洲化妝品協會(原Colipa)和歐(ōu)盟委員會共同(tóng)製定了化妝品安全報告指南,詳細解讀和列出了法(fǎ)規中關於CPSR的要求。該指南文件於2013年11月 25日由歐盟委員會作為委員會決議(Commission Decision)發布,歐盟(méng)委員會決議具有法律效率,因此企業必須遵從該決議。目前進行的毒理學風險評估(Toxicological Risk Assessment,TRA)以及類似的簡單升級版本已經不能夠滿足CPSR以及該指南(nán)的要求。指南更加(jiā)細化了新法規關於CPSR的要(yào)求。增加的(de)重要細(xì)則如下(xià):
1. 產品配方中的各組分需提供準確的含量,若無法提供定量信息則按照高劑(jì)量計算(suàn)。複雜成分如提取物或生物製(zhì)品等需(xū)提供純度標準及測試方法(fǎ)。
2. 產(chǎn)品中使用的原材料供應商(shāng)須(xū)在報告中(zhōng)指出,香料和香精必須提供生產商和產(chǎn)品代(dài)碼信息。
3. 化妝品包裝材料需要滿足食品接觸材(cái)料(Food Contact Material)的(de)標準並保證其(qí)穩定性。特別對於一些對光和空氣(qì)敏感的產品,其正確的貯存方法需要(yào)在標簽上得以體(tǐ)現。
4. 產品需要提(tí)供穩定性(Stability)報告,其中包括穩定性測定方法,防腐劑挑(tiāo)戰(zhàn)試驗報告,產品有效(xiào)期以及開蓋使用日期(Period-after-opening)。
5. 化妝品微生物方麵的要求進一步細化,高風險的原料需要注意微生物危(wēi)害(hài)。
6. 化妝品原料以及其包材中可能含有(yǒu)的雜(zá)質需要(yào)進行風(fēng)險評估並證明其技術上是不可避免的(如GMP條件下也無法避免)。
7. 化妝品所使用(yòng)的原料需要提供詳細的毒理檔案(Toxicological Profile of Substance,TPS),每(měi)一個原料需要提供其毒理學信(xìn)息,包括急性毒性(xìng)、刺激(jī)性、過敏性等共12項毒理學端(duān)點。
8. 化妝品原材料和成品的生產商都需要達到(dào)GMP(ISO 22716)標準。 由於原(yuán)料中的(de)雜質具有潛在的可以影響物質毒性的風險因(yīn)素,因此在評估雜質的安全性時可以引入毒理學關注閾(yù)值(TTC)作為有(yǒu)效的評估手段。
9. 若出現不良反應,則需在報告中評估(gū)其(qí)發生的可(kě)能性(xìng)和因果關係,出現嚴重的不良反應需上報歐盟(méng)成員國有關主管部門,並在CPSR報告中以附件形式存在並描述處理和解決方法。
10. 在評估報告結論中(zhōng)必須提到新的化妝品法規Regulation(EC)1223/2009,並(bìng)且明(míng)確指出產品是否符合(hé)新的化妝品法規。
11. 關於產品標簽,警告(gào)用語和使用說明(míng)在滿足新法規外還須參考相關(guān)文件,如(rú) Commission Recommendation 2006/647/EC 及其它與標簽相關(guān)的指導文件。為了(le)直觀地表達(dá)該(gāi)內容,可以在CPSR中附上產(chǎn)品的圖(tú)片。
12. 毒理風(fēng)險評估由定性評估變為定量評估。包括產品係統性的風險評估,配(pèi)方組合後的兼容性,穩定性,微生物,包裝,標簽(qiān)以(yǐ)及使用等各個方麵。產品所有(yǒu)的測試報(bào)告、技術文檔和其(qí)它相關信息(xī)須經過毒理風險評估師評估,並特別注意三歲以下兒童使用的產品,除了滿足新法(fǎ)規要求還需遵循歐盟消費者安全科學委(wěi)員會(SCCS)指南。
13. 當法律(lǜ)要求出現變化或更改(gǎi)時,產品的原材料發生改變(如更換供應商),使用(yòng)條件發生改變(biàn),以及監測到在(zài)正常使用(yòng)條件下不良反應發生率增加時,毒理風險評估(gū)師須對產品進行重新評估,確保化妝品(pǐn)安全(quán)報告(CPSR)保持同步更新(xīn)並(bìng)滿足新(xīn)法規要求。
14. 指南對於可(kě)以出具化妝品安全報告(CPSR)的安全評估(gū)師資質做了詳細(xì)的定義,非歐盟成員國承認的藥學(xué),毒理學等相關專業人員不得(dé)從事化妝品安全報告評估工作。並且(qiě)評(píng)估師的資質及相關學曆證明需要附在(zài)評估報告後。
相關(guān)信息/ RELATED INFO
MORE
服務熱線
微信掃一掃


返回頂部